我们很早就知道葡萄糖水平下降——常见于实体肿瘤的内部,会引起肿瘤细胞的凋亡,但其中的机制,尤其是葡萄糖水平如何被感应、传导再引起凋亡,并未得到明确的解析,甚至直接引申到葡萄糖会促进肿瘤细胞的生长。
2023年9月19日,厦门大学林圣彩课题组在Cell Research杂志发表题为“Low glucose metabolite 3-phosphoglycerate switches PHGDH from serine synthesis to p53 activation to control cell fate”的文章,阐述了在低葡萄糖,及其糖酵解的中间代谢产物三磷酸甘油酸(3-PGA)的水平显著下降的条件下,三磷酸甘油酸脱氢酶(PHGDH)能感知3-PGA在其酶分子上缺失,继而跟结构蛋白AXIN共形成一个大复合体,含有至少4个p53分子及其上游激酶HIPK2,导致p53的丝氨酸46(Ser46)位被磷酸化——该位点的磷酸化已被证明是p53被激活并行使凋亡功能的重要一环【1】。这个葡萄糖感知过程将葡萄糖缺乏的信号被递给了p53,并推动细胞的凋亡的过程,其意义可能是在第一时间参与消灭了新生的肿瘤细胞——因为在真实的生活中,一天当中人们总会有饥饿的时候,而我们体内能感知糖水平的下降;加之癌变细胞利用葡萄糖的速度会变快,体内的癌细胞就会在此时“自主”地死亡。

这个新发现可以追溯到林圣彩课题组于2004年在EMBO J上发表的,高表达的AXIN能作为架构蛋白激活p53的研究【2】,随后他们又发现了该机制其实是介导了细胞响应紫外线(UV)照射再引起凋亡的过程【3】。这以后,他们就一直执着于高表达或紫外线并不是体内的“生理”信号,也一直苦苦地思考着如何找到真正的生理意义,直到最近的这项新发现为止。在这项新发现中,他们首先探索了p53-Ser46的磷酸化是如何响应葡萄糖水平下降的。他们发现,无论是在HEK293、肝癌细胞系,还是病人样品中分离出的原代肝癌细胞(均为p53高表达)中,葡萄糖缺乏都会快速地(2小时之内)引发p53-Ser46的磷酸化。有意思的是,该位点的磷酸化和似乎是特异性地和低糖条件下糖酵解的中间代谢产物3-PGA的降低有关:敲低能够产生3-PGA的酶,包括糖酵解途径的磷酸甘油酸激酶(PGK)或者其上游的代谢酶,都能模拟低葡萄糖条件,引起p53-Ser46的磷酸化;而PGK的下游,如磷酸甘油酸变位酶(PGAM)等,则不影响p53-Ser46的磷酸化(图1)。同样地,改变糖酵解的其它“支路”,如磷酸戊糖途径、己糖酸途径,以及3-PGA流向丝氨酸合成途径的其它下游产物,都不会影响p53-Ser46的磷酸化(图1)。
在这样的基础上,他们进一步尝试去寻找感受3-PGA感应器,在筛选了多个能结合或者催化3-PGA的酶之后,他们发现了PHGDH就是这个感受器。当敲除PHGDH的时候,尽管3-PGA的水平没有明显变化,但p53-Ser46的磷酸化不再被葡萄糖水平所调节。而引入不能与3-PGA结合的PHGDH突变体(包括PHGDH-T57A和PHGDH-T78A),也就是使得PHGDH持续性地处于“饥饿”的状态,则能够在高葡萄糖条件下引发持续性的p53-Ser46的磷酸化;与之相对应的,引入能够结合3-PGA,但不能催化它的突变体(PHGDH-R135W和PHGDH-V261M),也就是使得PHGDH能够持续地结合3-PGA,则能够有效阻止低糖条件下,p53-Ser46的磷酸化。 那么PHGDH是如何调节p53-Ser46的磷酸化的呢?林圣彩课题组通过筛选已知的p53上游激酶,确认了葡萄糖调控的p53-Ser46的磷酸化是由HIPK2这个上游激酶所调节的。在这个思路下,他们进一步发现,PHGDH竟然就是通过他们课题组之前鉴定出的,由AXIN等因子介导的,响应UV刺激引发的p53-Ser46的磷酸化和细胞凋亡的途径【2,3】,在低葡萄糖条件下介导了上述功能!他们发现,AXIN对于PHGDH介导的p53-Ser46的磷酸化是必需的,且当PHGDH不结合3-PGA后,它能够结合AXIN,并引发TIP60、HIPK2等促进p53-Ser46磷酸化的因子被招募到AXIN上,而使得PIRH2这样的HIPK2的抑制因子远离AXIN和HIPK2,最终促进HIPK2对结合在AXIN上的p53的磷酸化(图1)——可以说是与UV引发p53-Ser46的磷酸化的机制如出一辙。这一针对于Ser46位点调控的机制上的保守性和它在感应不同的凋亡信号上的“殊途同归”,不由得不让人感慨生物体响应应激条件的简洁与精妙。
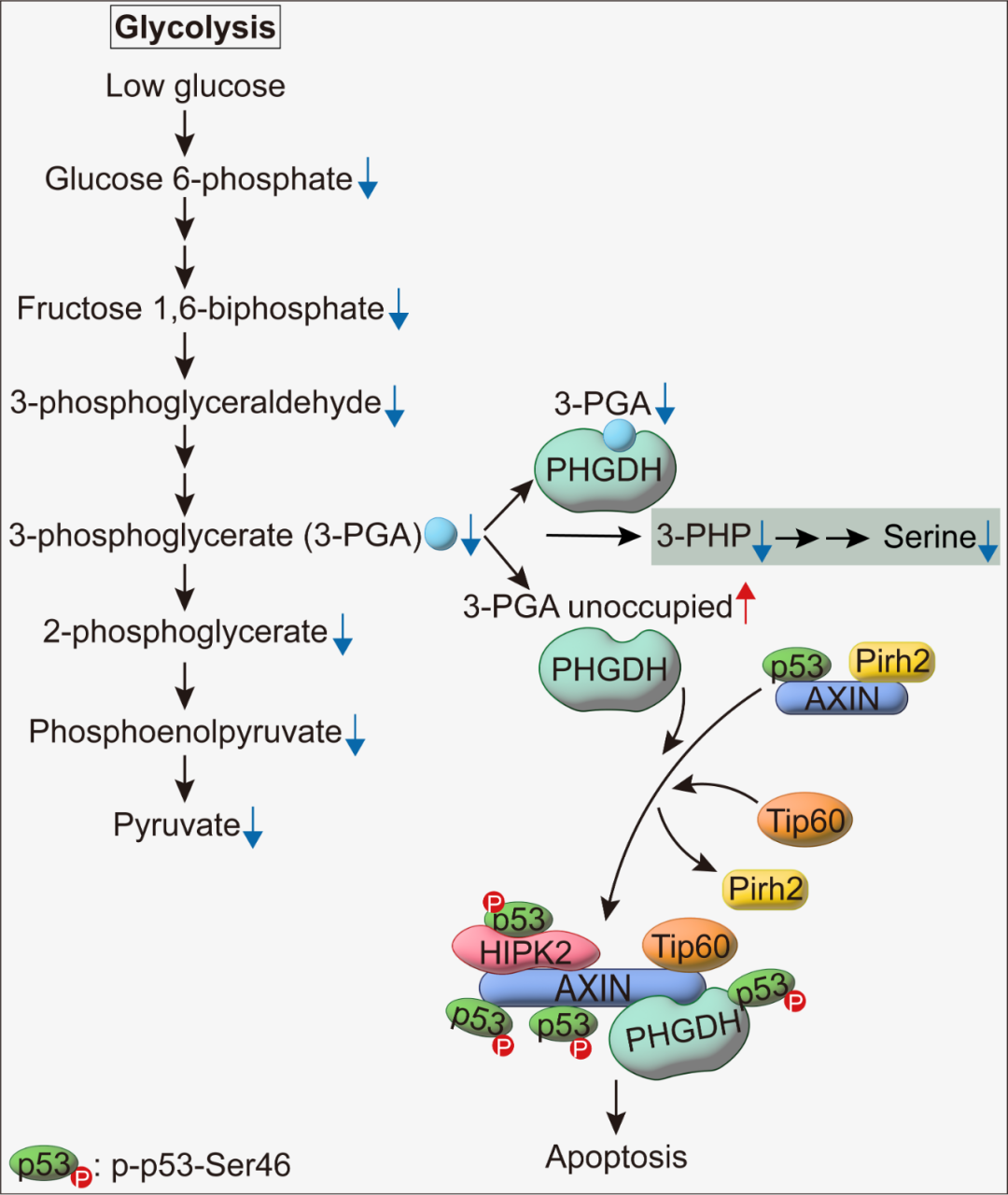
图1 PHGDH感知葡萄糖水平、调节p53-S46磷酸化和凋亡的机制 最后,作者也验证了在肿瘤环境中,上述机制对于肿瘤细胞凋亡的调控。在肝癌病人的肿瘤标本,以及(由DEN和四氯化碳)诱导的小鼠肝癌(HCC)模型中,他们的确在肿瘤的内部观察到了较高水平的p53-Ser46的磷酸化以及凋亡水平,这和此处的3-PGA浓度较低是相对应的。而在小鼠HCC模型中,通过腺相关病毒向小鼠的肝脏中导入不结合3-PGA的PHGDH突变体,则使得高3-PGA浓度的、肿瘤外部的p53-Ser46的磷酸化水平也被明显上调,呈现出和肿瘤内部相似的、较高的p53-Ser46的磷酸化和凋亡水平;而导入能够持续结合3-PGA的PHGDH突变体,则显著抑制了肿瘤内部的p53-Ser46的磷酸化和凋亡水平。与之对应的,不结合3-PGA的PHGDH突变体能够抑制HCC模型的肿瘤生长,持续结合3-PGA的PHGDH突变体则反之。进一步的验证表明,无论是敲除肝脏中的p53,还是采取卡路里限制的方式,持续性地降低HCC模型中的3-PGA水平,都能够阻断两种PHGDH突变体对于肿瘤的影响。这充分说明了PHGDH感应葡萄糖水平调节凋亡的功能在真实肿瘤环境下的关联性。
如上所述,本文不但揭示了低葡萄糖条件下,p53决定细胞命运的“流程”,也为林圣彩课题组近20年来揭示的由AXIN等调控的p53的找到了一个对应的生理条件并找到了其感应机制,而再次发表关于p53和细胞凋亡的文章并能够“拾回(retrieve)”那时的吉光片羽,也再次让我们看到了林圣彩课题组一如既往的执着、坚韧的风格。对此,林圣彩也感慨颇深,他介绍说,从2004年他们发现并报道了p53-Ser46的磷酸化能够被AXIN所促进【2】(图2),再到2009年他们报道了TIP60与PIRH2这两个“一正一反”的调节AXIN-HIPK2对p53-Ser46磷酸化的机制【3】(图3)的这整个过程,他们用的都是UV这一刺激信号。UV在那个年代,确实是研究p53和细胞凋亡的经典上游,但它实际上是一个很抽象的概念或者说上游信号:因为当时就已经发现,和p53有关的很多实体肿瘤,比如肝癌、胰腺癌,都是深埋于我们体内,平时是不可能受到UV刺激的,所以“我那时候就有个信念,就像是一种追求美学的执念一样,一直觉得这样一个精巧的决定细胞命运的通路,应该能找到它真正的生理归宿。可是在那个年代肿瘤模型还远远没有现在这么丰富,而对于代谢及其代谢产物功能的研究更还处于非常早期的阶段,所以这个谜团一直到了十多年以后,到如今的这篇文章才得以解析。也正因为有着这样的思考,才让他们这么多年以来一直保持着对p53、对细胞命运调控的敏感,也才最终“念念不忘必有回响”的。
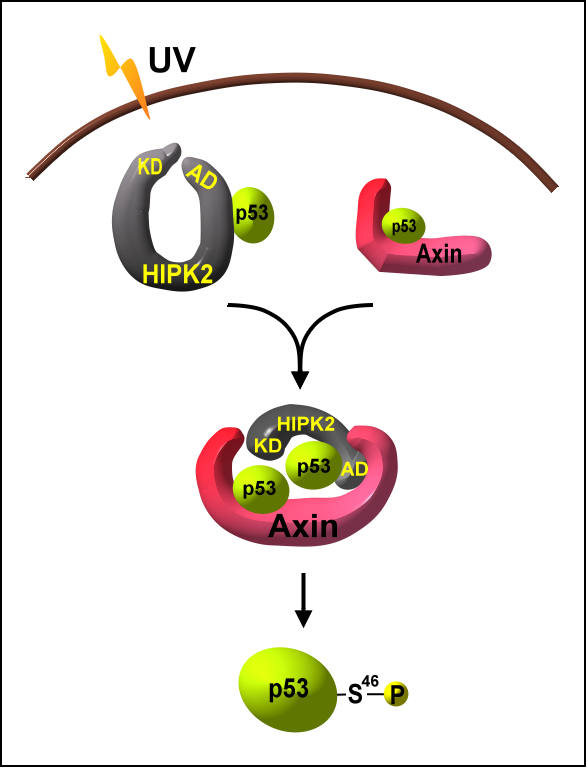
图2 AXIN促进UV诱导p53-S46磷酸化【2】
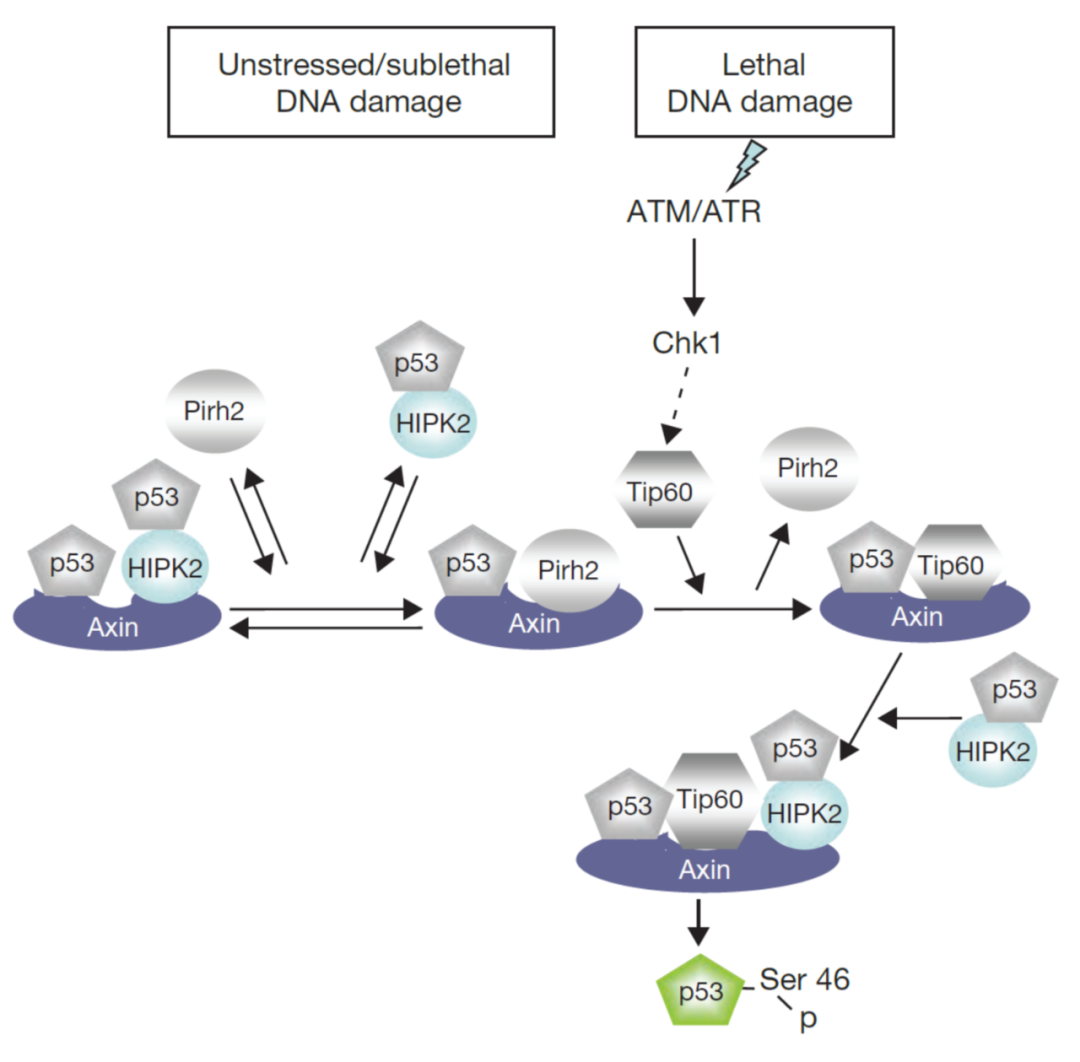
图3 TIP60和PIRH2协同AXIN调控p53-S46磷酸化和凋亡的机制【3】
此外,本文所揭示的机制也引申出了多个关于肿瘤细胞命运调控的、有待研究的问题。据林圣彩介绍,PHGDH和肿瘤的关系,从最早被David Sabatini和Matthew Vander Heiden实验室分别发现在原位肿瘤组织中高表达以来【4,5】,其通过促进丝氨酸的从头合成以及一碳单位的生成以促进肿瘤发展的功能已被广泛报道和研究【6,7】从而初步揭开了其在肿瘤发展的不同时程中的复杂作用。然而近年来,PHGDH在肿瘤发生和发展中的非酶功能,如最近发现的它作为转录因子调节线粒体呼吸链的表达【8】,以及通过结合并抑制磷酸果糖激酶从而抑制己糖酸途径及其介导的糖基化从而抑制肿瘤的转移【9】等作用,也被越来越多地重视起来,而本研究也是在此基础上的一次新的拓展。因此有理由相信在未来,代谢酶的非酶功能和其通过感应、传递代谢产物的“信号”来介导多个生物学过程,将会被提升到和催化功能同等重要的地位。最后,p53-S46的磷酸化在不同应激条件下决定细胞的凋亡过程中的角色也值得深究:仅就葡萄糖缺乏这一条件来看,本文发现,它主导的是短期缺糖时细胞的凋亡;而本文和前人都发现,当细胞缺糖的时间进一步延长后,细胞的凋亡即交由p53的表达量和其转录活性决定【10,11】,且前者还在最近被发现是直接与葡萄糖介导的糖基化相关联的【12】。因此,在肿瘤组织中,p53-S46的磷酸化要体现到肿瘤的最终大小,很可能是通过一种散发(sporadic)而后积累的机制。因此,了解肿瘤发生过程中的不同“时空”下的细胞命运决定机制,结合代谢微环境变化,乃至其中多种p53突变的发生,将有助于我们最终了解肿瘤发生和发展的进程。
厦门大学附属中山医院肝胆外科的周建寅主任提供了本项目所用的肝癌样本,为本项目的研究提供了不可或缺的支持,中国科学院大连化学与物理研究所的朴海龙研究员一如既往地支持了本项目所涉及到的多个组织、细胞中的代谢物含量测定,福建省肿瘤医院的兰斌和王雪枫博士为帮助建立了多个HCC模型。
原文链接:https://www.nature.com/articles/s41422-023-00874-4
参考文献
1. M. C. Liebl, T. G. Hofmann, Cell Fate Regulation upon DNA Damage: p53 Serine 46 Kinases Pave the Cell Death Road. Bioessays 41, e1900127 (2019).
2. Y. Rui et al., Axin stimulates p53 functions by activation of HIPK2 kinase through multimeric complex formation. The EMBO journal 23, 4583-4594 (2004).
3. Q. Li et al., Axin determines cell fate by controlling the p53 activation threshold after DNA damage. Nature cell biology 11, 1128-1134 (2009).
4. R. Possemato et al., Functional genomics reveal that the serine synthesis pathway is essential in breast cancer. Nature 476, 346-350 (2011).
5. J. W. Locasale et al., Phosphoglycerate dehydrogenase diverts glycolytic flux and contributes to oncogenesis. Nat Genet 43, 869-874 (2011).
6. J. Y. Zhao et al., A retrospective overview of PHGDH and its inhibitors for regulating cancer metabolism. Eur J Med Chem 217, 113379 (2021).
7. W. Shunxi et al., Serine metabolic reprogramming in tumorigenesis, tumor immunity and clinical treatment: Serine metabolic reprogramming in cancer. Adv Nutr, (2023).
8. Y. Shu et al., Non-canonical phosphoglycerate dehydrogenase activity promotes liver cancer growth via mitochondrial translation and respiratory metabolism. The EMBO journal 41, e111550 (2022).
9. M. Rossi et al., PHGDH heterogeneity potentiates cancer cell dissemination and metastasis. Nature 605, 747-753 (2022).
10. D. Khan et al., Reversible induction of translational isoforms of p53 in glucose deprivation. Cell Death Differ 22, 1203-1218 (2015).
11. L. Wang, R. F. Minchin, N. J. Butcher, Arylamine N-acetyltransferase 1 protects against reactive oxygen species during glucose starvation: Role in the regulation of p53 stability. PLoS One 13, e0193560 (2018).
12. Y. Su et al., Glucose-induced CRL4(COP1)-p53 axis amplifies glycometabolism to drive tumorigenesis. Molecular cell 83, 2316-2331 e2317 (2023).